Hải quân Mỹ chá» trÃch hà nh vi xua Äuá»i máy bay của Trung Quá»c trên Biá»n Äông
Tin tức lớn, D-Friends: loại insulin mới có thể hít vào được gọi là Afrezza vừa mới được FDA thông qua!
Lần thứ ba là sự quyến rũ cho việc tạo ra insulin insulin hít này, lần thứ hai để vượt qua quá trình điều chỉnh của U. sau khi Exubera của Pfizer thất bại trong một thập kỷ trước.
Vào ngày thứ sáu, công ty công nghệ sinh học của California là MannKind Corp. cuối cùng đã có được giấy chứng nhận hợp pháp cho thiết bị Afrezza.

Afrezza là loại insulin tác động cực nhanh ở dạng bột được thiết kế như một loại insulin trước bữa ăn cho người lớn (chưa cho trẻ em ) với bệnh đái tháo đường type 1 hoặc type 2. Mục đích của nó là tăng đột biến đường trong máu sau bữa ăn, có nghĩa là sử dụng với điều trị bằng insulin hiện tại và không có nghĩa là phải điều trị bằng insulin đơn độc.
Insulin bột được điều khiển thông qua một ống thở bằng còi gọi là Dreamboat, được phát triển sau khi FDA đầu tiên tròn và gây ra sự chậm trễ vì cơ quan này muốn có nhiều nghiên cứu lâm sàng sử dụng ống hít mới. Bột tan ngay khi hít phải vào phổi, và insulin sẽ nhanh chóng đổ vào máu để bắt đầu hoạt động. Afrezza lên đến đỉnh điểm trong vòng 12 đến 15 phút và thoát khỏi hệ thống trong vòng một giờ, so với insulin ngắn hạn hiện tại, thường mất ít nhất 20 phút để đá vào, đạt đỉnh điểm ở 2-3 giờ, và có thể ở lại trong hệ thống vì dài như năm giờ.
Tất nhiên, sự hấp dẫn lớn nhất là nó không đòi hỏi kim chỉ, nhưng chỉ là một ít hít cầm tay mà thực sự trông giống như một tiếng còi.Dreamboat có thể được vứt bỏ sau 15 ngày để ngăn chặn bất cứ sự tích tụ bột nào bên trong có thể làm tắc nghẽn thiết bị. Không giống insulin truyền thống, không cần điện lạnh, mà được giữ ở nhiệt độ phòng. Mỗi hộp mực sử dụng một lần sẽ chứa 4 hoặc 8 đơn vị, và vào thời điểm Afrezza được thương mại hoá, có thể có hộp mực 12 hộp.
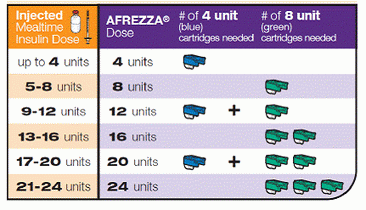
Đây là cách bạn có thể dùng liều này, chuyển đổi liều tiêm insulin hoặc liều lượng bolus hiện nay thành liều lượng hít một cách thân thiện với Afrezza:
Cá nhân, dường như không có nhiều chất insulin để che một số bữa ăn tôi ăn yêu cầu liều cao hơn … Tôi sẽ trải qua một loạt các hộp mực nhỏ đó. Vì vậy, đối với một số NKT, thiết bị này có thể mang lại một thách thức hậu cần về việc dễ dàng định lượng số tiền chúng ta cần …? Nhưng một lần nữa, đây có thể là một công cụ tốt để hạ thấp đường huyết cứng đầu với liều lượng hiệu chỉnh.Trong một cuộc trò chuyện qua điện thoại vào cuối ngày hôm qua, tổng thống Hakan Edstrom của MannKind nói với chúng tôi rằng công ty vẫn chưa hoàn tất thỏa thuận với các đối tác tiềm năng để sản xuất và phân phối Afrezza. Nhưng nó đã gần gũi, và trong cuộc hội đàm với một số công ty để hoàn thành một quan hệ đối tác càng sớm càng tốt.
Sự chấp thuận này là sự phát triển của HUGE, và đã là một thời gian dài sắp tới, tám năm kể từ khi nhiệm vụ này bắt đầu bởi Alfred Mann - người thành lập Minimed trước khi nó được mua lại bởi Medtronic. Chúng tôi đã theo dõi câu chuyện của Afrezza trong nhiều năm ở mỏ
Mine
- từ những ngày nộp đơn đầu tiên của FDA khi MannKind có thiết kế ban đầu của nó, tới phạm vi gần đây hơn về cách Afrezza được sử dụng trong Tụy nhân tạo các thử nghiệm lâm sàng.
Cho đến nay, chi phí này chỉ là 1 đô la. 8 tỷ (để có được Afrezza đến thời điểm này, và phần lớn số tiền đó đã được sử dụng để trả cho 60 + các thử nghiệm lâm sàng có liên quan đến 6, 500 bệnh nhân. Wowza!
Trước khi tái phân phối FDA vào mùa thu năm ngoái, chúng tôi đã nghe MannKind tự hào về các nghiên cứu lâm sàng Giai đoạn III vào mùa hè năm ngoái bao gồm 500 + người khuyết tật loại 1 tại U. và trên toàn cầu, cho biết công ty đã sẵn sàng thử lại FDA. Ủy ban cố vấn đã họp vào ngày 1 tháng 4 năm nay đã bỏ phiếu từ 13 đến 1 rằng Afrezza đã được an toàn và có hiệu quả để được chấp thuận để điều trị bệnh tiểu đường týp 1, và David Cooke đã bỏ phiếu cho rằng những rủi ro này vượt trội hơn các lợi ích đối với loại 1 giây.Ông chỉ ra một đánh giá nội bộ của FDA cho thấy một số bệnh nhân dùng Afrezza ngừng điều trị sau khi chứng co thắt phế quản, ho, và suy giảm chức năng của phổi. Tuy nhiên, không ai trong số những mối quan tâm này được đưa ra trong cuộc biểu quyết đối với Afrezza đối với việc sử dụng loại 2 và ủy ban đã quyết định nhất trí với một cuộc bỏ phiếu 14-0.
Khi phê duyệt Afrezza, FDA đã kèm theo một số quy định về an toàn, hiệu quả và sử dụng bệnh nhân:
Không nên dùng cho người bị tiểu đường hút thuốc, cũng như không điều trị bệnh đái tháo đường do đái tháo đường (DKA).
Afrezza chỉ được chấp thuận cho người lớn chứ không phải trẻ em. Tuy nhiên, cơ quan này yêu cầu một thử nghiệm lâm sàng sau thị trường để đánh giá mức độ an toàn và sử dụng ở bệnh nhi.FDA yêu cầu cảnh báo đóng hộp, khuyên một số bệnh nhân hen phế quản và bệnh phổi tắc nghẽn mạn tính (COPD) đã sử dụng Afrezza đã trải qua tình trạng co thắt phế quản cấp tính. Do đó, những người có bệnh phổi mạn tính, hen suyễn hoặc COPD, không nên dùng Afrezza vì nguy cơ này. Các phản ứng phụ thường gặp nhất liên quan đến Afrezza trong các thử nghiệm lâm sàng là chứng hạ đường huyết, ho, đau cổ họng hoặc kích ứng.

Các nghiên cứu sau thị trường khác được yêu cầu trên Afrezza, như: thử nghiệm lâm sàng để đánh giá nguy cơ tiềm ẩn nguy cơ ác tính phổi khi sử dụng (thử nghiệm này cũng sẽ đánh giá nguy cơ tim mạch và tác động lâu dài của Afrezza đối với chức năng phổi); và hai thử nghiệm lâm sàng kép glucose-pharmacokinetic dược động học-dược động học, một để mô tả phản ứng liều và một trong những đặc tính biến đổi trong-đối tượng.
Edstrom nói với chúng tôi rằng họ đang có kế hoạch bắt đầu các thử nghiệm nhi khoa càng sớm càng tốt, sẽ bắt đầu vào giữa năm 2015 một cách thực tế. Điều đó có nghĩa là Afrezza có thể không được chấp thuận cho trẻ bị tiểu đường cho đến năm 2017, và quy trình điều chỉnh có thể khác nhau tùy thuộc vào những nghiên cứu sau khi thị trường và kinh nghiệm sử dụng người lớn cho thấy trong thời gian chờ đợi.
- Và bất chấp ánh sáng màu xanh lá cây của FDA, không có gì đảm bảo rằng Afrezza sẽ thấy thành công trong thương mại hoặc NKT sẽ sử dụng nó. Như đã nói, MannKind chưa đảm bảo bất kỳ đối tác dược phẩm nào đã sẵn sàng để bán Afrezza. Nhưng nếu thu nhập của MannKind vào tháng 5 là bất kỳ dấu hiệu nào cho thấy điều gì sắp xảy ra, mối quan hệ hợp tác tiềm năng sẽ không còn xa nữa.
- Theo quan điểm của các nhà đầu tư, nhiều người hoài nghi dựa trên insulin Insubera đã bị hít vào đã hình thành nhiều cuộc thảo luận về Afrezza trong vài năm gần đây. Sản phẩm Pfizer-Sanofi đã được kéo ra khỏi thị trường trong năm 2007 sau hơn một năm bán lẻ - dẫn đến mức kỷ lục 2 USD. 8 tỷ mất mát cho các nhà cung cấp.
- Tất nhiên, MannKind tuyên bố rằng Afrezza khác biệt đáng kể, chủ yếu là vì Exubera đã sử dụng một ống ngâm chân dài và có liên quan đến nguy cơ ung thư phổi cao hơn mà Pfizer không thể vượt qua.
- Chúng ta sẽ thấy cộng đồng D nghĩ gì với Afrezza, đặc biệt là với tất cả các nghiên cứu thử nghiệm lâm sàng AP gần đây. Cho dù đó là đủ để thuyết phục quần chúng vẫn chưa rõ ràng …
- Hít vào tin tức bây giờ, và chúng ta sẽ thấy chúng ta phải thở ra bao lâu và biến sự phấn khích này thành bán hàng thực tế và sử dụng rộng rãi.
Khước từ trách nhiệm
: Nội dung được tạo ra bởi nhóm Điều trị Bệnh tiểu đường. Để biết thêm chi tiết, bấm vào đây.
Khước từ trách nhiệm
Nội dung này được tạo ra cho Diabetes Mine, một blog về sức khoẻ người tiêu dùng tập trung vào cộng đồng bệnh tiểu đường. Nội dung không được xem xét y khoa và không tuân thủ các nguyên tắc biên tập của Healthline. Để biết thêm thông tin về sự hợp tác của Healthline với Bệnh tiểu đường, vui lòng nhấn vào đây.
Bơm Insulin tích hợp đầu tiên trên thế giới với sự giám sát liên tục được FDA chấp thuận

ĐáI tháo đường Tin tức: Dexcom SHARE được chấp thuận của FDA!

Hít Insulin Afrezza đã được FDA chấp thuận

FDA đã chấp thuận một sản phẩm insulin hít mới. Afrezza là insulin tác động cực nhanh ở dạng bột, được thiết kế như một bữa ăn cho người bệnh tiểu đường loại 1.

